Un biólogo de Estepona lidera la creación de la médula ósea humana más avanzada en un laboratorio
Este proyecto permitirá estudiar ‘‘cánceres de sangre y también cualquier tipo de tumor sólido que pueda tener metástasis’’, argumenta
El SAS hará mamografías, ecografías y biopsia el mismo día en los cánceres con altas sospechas

Nuevo avance en la investigación oncológica. La médula ósea es uno de los tejidos más difíciles de estudiar dentro del cuerpo humano al encontrarse en el interior de los huesos, lo que impide acceder a ella. Pero el biólogo esteponero Andrés García ha liderado un equipo de la Universidad de Basilea y del Hospital Regional que ha conseguido crear en un laboratorio "la médula ósea humana más avanzada hasta el momento". Un modelo que abre muchas posibilidades para estudiar enfermedades que afecten a este tejido, entre ellas, los cánceres de sangre, al igual que otros tipos de tumores sólidos, como el de mama o próstata, que puedan tener metástasis en la médula ósea.
Este proyecto se trata de un antes y un después en la investigación porque ‘‘lo que sabíamos hasta el momento de la médula ósea se debe a estudios utilizando animales de investigación’’, argumenta. Aunque estas iniciativas han sido el punto de partida de muchos avances y ha permitido conocer la fisiología y funcionamiento de la médula ósea, ‘‘nosotros no somos idénticos a estos animales y no sabemos si los resultados se pueden trasladar al cuerpo humano’’, puntualiza. A partir de ahora, con este nuevo modelo creado por García y su equipo, ‘‘se podrá estudiar enfermedades en el contexto humano sin tener que depender ellos’’, apunta.
Una vez que se ha conseguido generar este modelo, el siguiente paso es hacer uso de él. García lo explica en un caso concreto: permitiría estudiar una enfermedad como la leucemia directamente sobre este tejido humano. ‘‘Ahora tenemos la posibilidad de cultivar células leucémicas humanas en el laboratorio utilizando este modelo e investigarlo en un contexto humano para saber las causas de la enfermedad’’, explica el biólogo, además de conocer distintos fármacos que funcionan contra esta ella. De momento, no se atreve a fijar una fecha en la que este modelo actúe directamente sobre el paciente, ‘‘porque en la ciencia es difícil de pronosticar’’. Aunque piensa que ‘‘en tres o cuatro años podemos ver algún caso’’, apunta.
El aspecto más importante del modelo es su realismo porque es un tejido que ‘‘incluye células de hueso, vasos sanguíneos, por supuesto células del sistema inmunológico y células neuronales también’’, explica García. Hasta el momento, los modelos que se han intentado desarrollar carecían de algunas de estas células, mientras que este permite ‘‘reproducir la complejidad que encontramos en la médula ósea humana’’, argumenta.
Esta creación ha supuesto enfrentarse a diferentes retos antes de conseguir el resultado final. Pero García destaca la aplicación de células madres pluripotenciales inducidas, ‘‘un tipo que se extrae del cuerpo y se reprograman para convertirlas en células madres’’, defiende. El uso de ellas permite, posteriormente, dirigirlas para diferenciarlas de otros tipos de células, según el interés del científico, y el objetivo de este grupo era distinguirlas como médula ósea, que ‘‘se consiguió, pero no fue sencillo’’. En la actualidad, es una estrategia que se desarrolla en los laboratorios para crear organoides, ‘‘unos tejidos que tratan de replicar las propiedades de los tejidos humanos’’. Se trata de estructuras 3D para estudiar órganos y para desarrollarlos es necesario aplicar las células madres pluripotenciales inducidas.
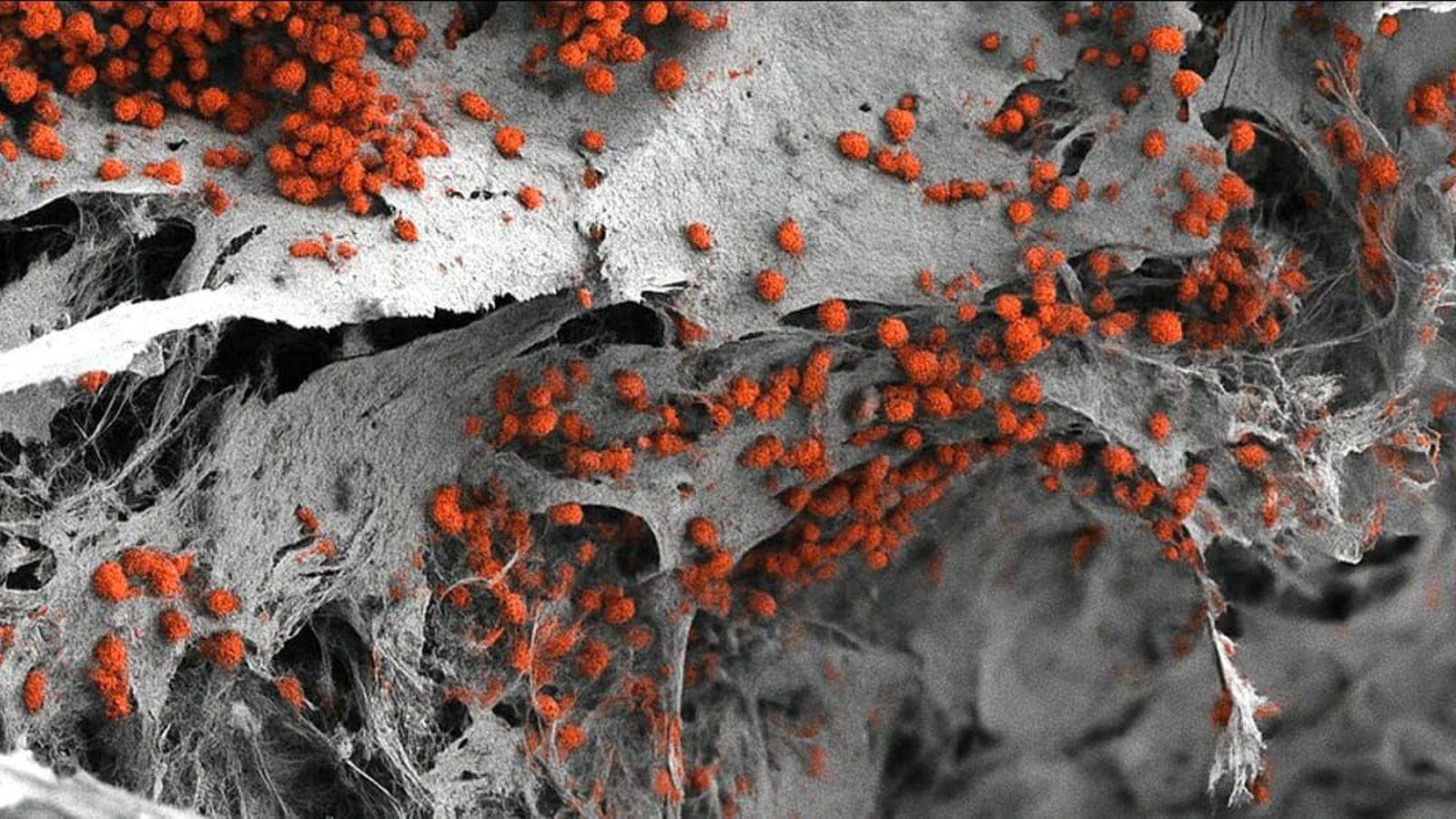
Lo más sorprendente del proyecto fue ver ‘‘la capacidad de las células para organizarse de forma espontánea en este tejido tridimensional’’, manifiesta. La reacción de las células en este modelo aún sorprende a García: ‘‘No comprendemos cuáles son estas señales y cómo este proceso ocurre en precisión, ni los mecanismos detrás de esto, pero las células hacen su trabajo’’. El biólogo malagueño lo cataloga como ‘‘la magia del modelo’’.
García y su equipo, tras el hito conseguido, tienen otro reto por delante: ‘‘Una de las posibilidades de este modelo es tratar de hacerlo específico para cada paciente’’. La idea es recoger células de un individuo y tratar de generar el modelo utilizando, únicamente, estas. Este avance se podría ‘‘utilizar, por ejemplo, en el contexto de los cánceres para testar medicamentos, terapias y ver cuál funciona mejor para ese individuo en concreto’’, explica el biólogo.
El proyecto se inició hace cuatro años y también ha contado con la cooperación de instituciones suizas y de fuera del país. Ha sido un proceso complejo, ‘‘incluso, después del primer año, tuvimos tantos problemas técnicos que estuvimos pensando cancelarlo’’, cuenta García como anécdota. Sin embargo, los resultados comenzaron a cambiar y el proyecto salió adelante.
Andrés García es natural de Estepona, estudió el Grado de Biología en la Universidad de Málaga e hizo un máster en investigación biomédica en la Universidad Autónoma de Madrid. También ha trabajado en el Reino Unido, en Cambridge, y ahora su vida laboral se desarrolla en Basilea. ‘‘Con el paso de los años uno va adquiriendo más responsabilidades y acabamos trabajando en este proyecto, que al final, ha tenido esta buena repercusión y creemos que ha sido un éxito’’, culmina.
También te puede interesar
Lo último







